2023-08-29
近日,儿药领域再传利好消息!
为进一步做好保障儿童用药工作,促进儿童适宜品种、剂型、规格的研发创制和申报审评,满足儿科临床用药需求,国家卫生健康委会同科技部、工业和信息化部、国家医保局和国家药监局,通过组织专家遴选、社会公示等,研究制定《第四批鼓励研发申报儿童药品清单》。
 (图片来源:国家卫健委官网)
(图片来源:国家卫健委官网)
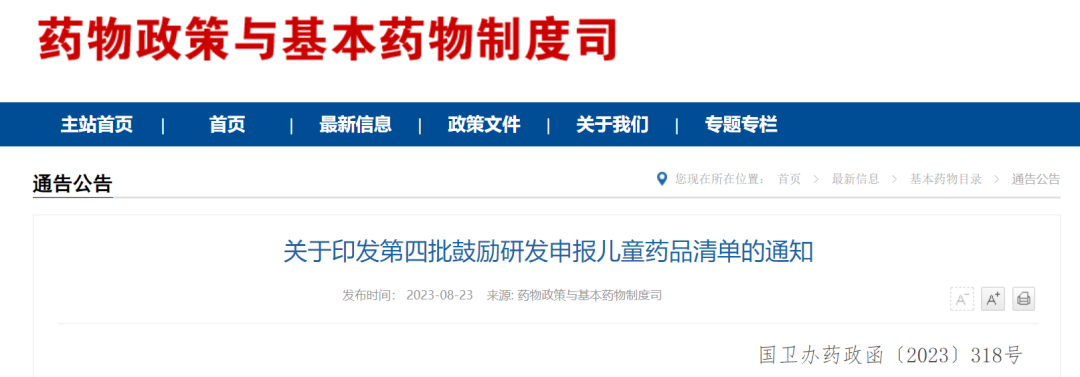
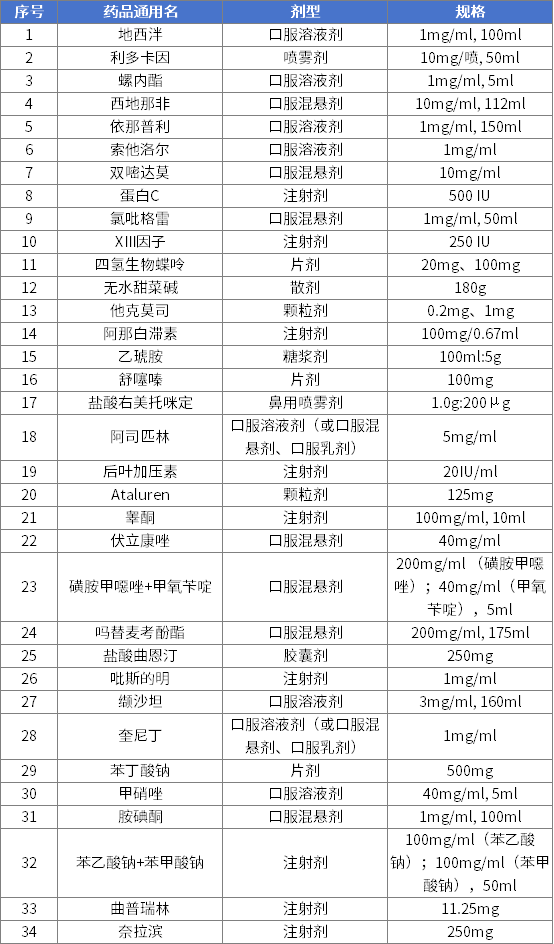
第四批清单有24个品种,涉及30个品规、9种剂型,覆盖神经系统用药、消化道和新陈代谢用药、抗肿瘤药及免疫调节剂等治疗领域。
第四批鼓励研发申报儿童药品清单
《第四批鼓励研发申报儿童药品清单》主要特点
一是突出临床用药需求。清单中绝大多数药品国内暂无通用名上市,有助于填补国内用药空白;
二是贴近儿童用药特点。多为口服溶液剂、鼻用散剂等低龄儿童适宜剂型,且同品种下规格更为丰富,能更好匹配不同年龄段的儿童用药需求;
三是关注罕见病患者群体。经多部门组织专家遴选论证,听取临床一线意见,遴选药品中包括了部分罕见病用药;
四是兼顾企业研发积极性。清单遴选过程中,通过数据分析和专家论证等方式综合评估了品种潜在的临床应用前景和市场空间。
鼓励研发申报儿童药品清单遴选的主要考虑
《第四批鼓励研发申报儿童药品清单》综合考虑临床用药必需性和企业研发可行性。一是坚持临床需求为导向。跟进全球最新临床进展,将近年来国外已上市国内未上市的儿童药品和国内已上市但无儿童适宜剂型规格药品作为重点考虑,着重选择安全性、有效性、适宜性高的品种。二是兼顾企业研发可行性。经多部门组织专家共同研究论证,综合考虑生产工艺难度、原料药供应、专利侵权风险等因素。
前三批《鼓励研发申报儿童药品清单》实施情况
为落实《关于保障儿童用药的若干意见》,进一步做好保障儿童用药工作,促进儿童适宜品种、剂型、规格的研发创制和申报审评,满足儿科临床用药需求,2016年以来,国家卫生健康委会同有关部门,先后制定并发布了三批含105种药品的《鼓励研发申报儿童药品清单》。
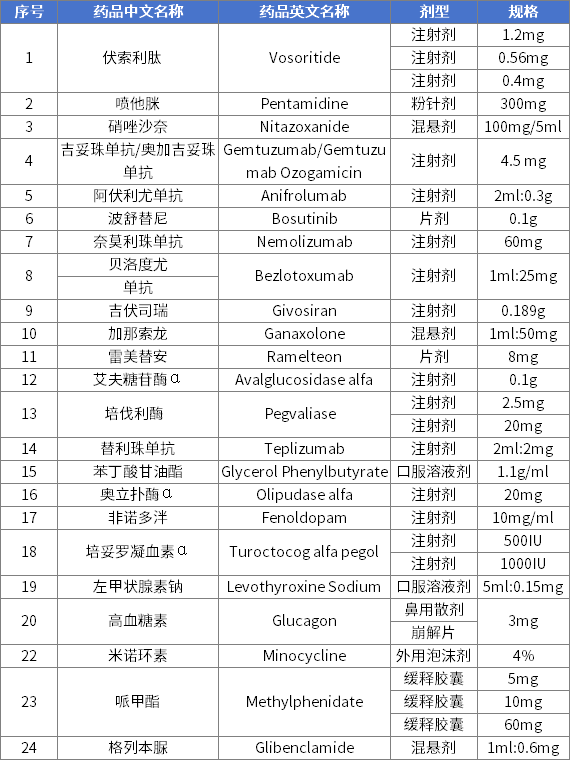
首批鼓励研发申报儿童药品清单
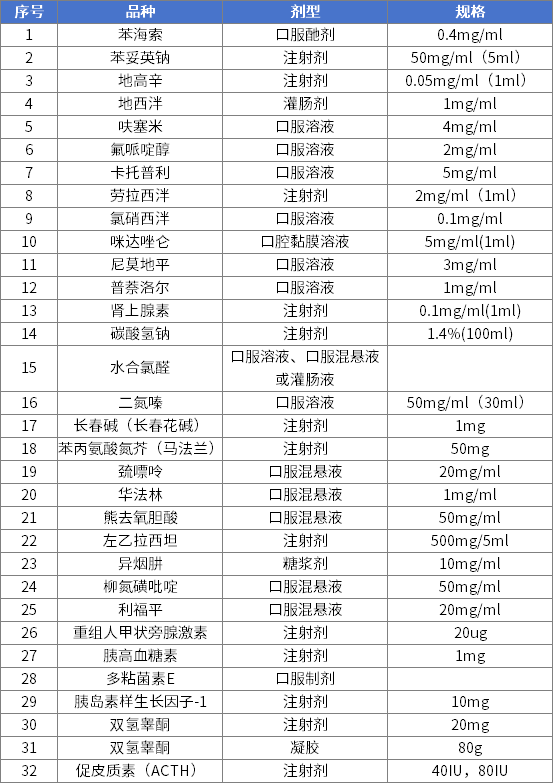
第二批鼓励研发申报儿童药品清单
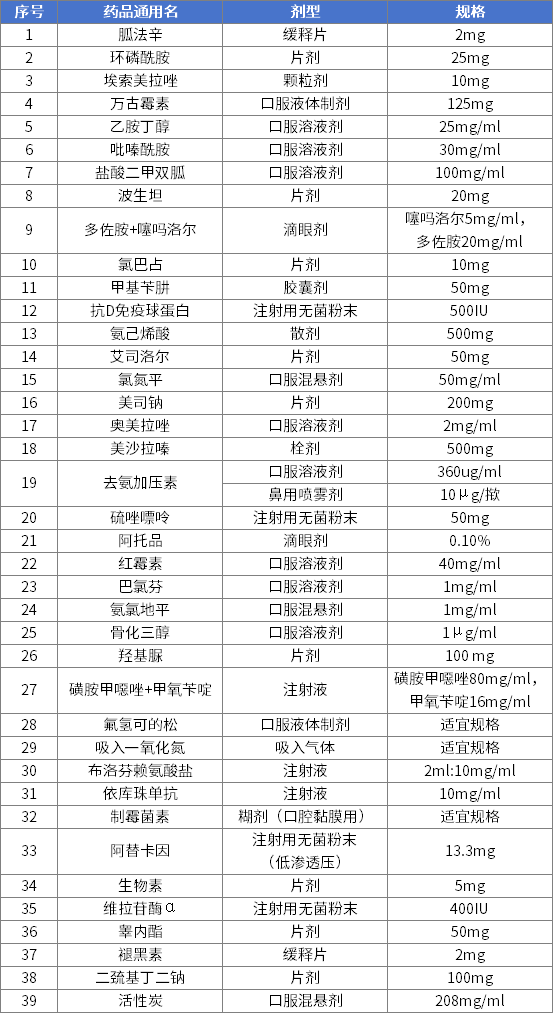
第三批鼓励研发申报儿童药品清单
前三批清单中已有23个药品获批上市,覆盖抗肿瘤药及免疫调节剂、神经系统用药、精神障碍用药等8个治疗领域,其中有6个药品是罕见病用药。主要有以下成效:
一是填补国内用药空白。前三批清单中已上市药品中的多个品规为清单发布后首次获批上市,覆盖精神障碍用药、抗肿瘤药等多类重大疾病用药,也涉及儿童常见的呼吸系统用药、消化系统用药等,拓宽了相关领域的用药选择。
二是切实提升药品可及性。前三批上市品种多为低龄儿童适宜剂型,包括口服混悬剂、口腔黏膜溶液、糖浆剂等多种儿童适宜剂型,既改善临床用药不足的现状,促进药物合理使用,又提高儿童用药顺应性,提升临床用药可及。
三是有效引导企业研发。前三批清单坚持临床需求导向,推进儿童药品的研发申报,鼓励企业合理调整研发战略布局,避免研发盲目性,提升了企业研发生产积极性,促进了儿童用药生产及资源分配。
鼓励研发申报儿童药品清单相关配套政策
为保障鼓励研发申报儿童药品清单的顺利实施,国家卫生健康委会同科技部、工业和信息化部、国家医保局、国家药监局建立跨部门信息共享、沟通会商和协同创新机制,分别按职责和鼓励研发申报儿童药品政策要求,推进鼓励研发申报儿童药品研发、注册、生产、使用、报销等配套政策衔接协同。
科技部门加大鼓励研发申报儿童药品的科研扶持力度,引导提升我国儿童药品研发综合水平。
工业信息化部门鼓励儿童药品相关产业项目建设,支持儿童药品产业发展。
卫生健康部门加强鼓励研发申报儿童药品的科研项目扶持和合理使用指导,优先考虑纳入国家基本药物目录。
医疗保障部门优先将鼓励研发申报儿童药品纳入国家基本医疗保险药品目录。
关于贝美药业

贝美药业专注于儿童化学处方药领域,总部位于中国深圳,集研发、引进、生产、销售于一体,已布局30余款儿童产品,其中拥有全球权益和自主知识产权的2类创新药有3个,覆盖了呼吸系统、抗感染(抗菌)、神经系统、消化系统、内分泌、五官科等领域。
贝美药业与Hetero、Cipla、EMP、Deva、Dr.Reddy's、LTS、MedPharma、Synthon、NTC等公司建立了长期的合作伙伴关系,并于2021年完成了超亿元的A轮和B/B+轮融资,进一步加速为中国儿童患者提供精准给药、口感好且高质量标准的产品,解决临床未被满足的需求,旨在成为中国儿童药领域的探索者和创新者。
如需了解更多信息,请访问http://www.beimeiyaoye.com